XFEL: Forschende filmen Antibiotikaresistenz in Zeitlupe
Forschende filmen Antibiotikaresistenz in Zeitlupe
Einem internationalen Forscherteam ist es gelungen, am Röntgenlaser European XFEL in Schenefeld bei Hamburg einen für die Entstehung von Antibiotika-Resistenzen wichtigen Reaktionsschritt zu beobachten. Dabei ist eine Art molekularer Film entstanden, der die sehr schnelle Reaktion des Enzyms Beta-Lactamase aus Tuberkulose-Bakterien mit dem Cephalosporin-Antibiotikum Ceftriaxone in Zeitlupe festhält. Die Ergebnisse hat das Team heute in IUCrJ, dem Fachjournal der International Union of Crystallography veröffentlicht.

Resistenzen entstehen unter anderem, wenn Bakterien die Fähigkeit erwerben, die gegen sie eingesetzten Antibiotika zu inaktivieren. Viele resistente Bakterien bilden das Enzym Beta-Lactamase, das beta-Lactamantibiotika unwirksam machen kann, die zu den am häufigsten eingesetzten Antibiotika zählen. Die Forschenden unter Leitung von Marius Schmidt von der University of Wisconsin-Milwaukee haben nun an der Experimentierstation SPB/SFX des European XFEL den ersten Schritt dieser Inaktivierung untersucht und beobachtet, wie das Antibiotikum innerhalb von Millisekunden (tausendstel Sekunden) an Beta-Lactamase aus resistenten Tuberkulose-Bakterien bindet. Außerdem gingen die Forschenden der Frage nach, wie der Enzym-Inhibitor Sulbactam mit dem Bakterienenzym reagiert. Sulbactam kann, gleichzeitig mit den Antibiotika verabreicht, deren Wirksamkeit wiederherstellen, indem es an das Bakterienenzym bindet. Die so blockierte Beta-Lactamase kann die Antibiotika nicht mehr unwirksam machen, so dass diese wieder wirken.
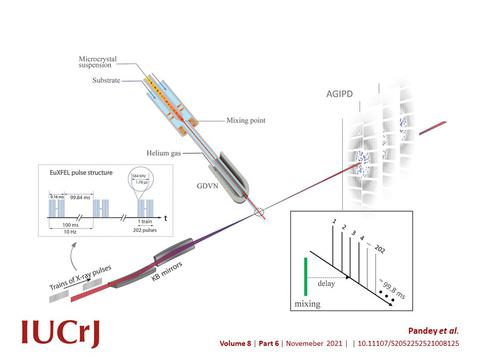
Für die Untersuchung von Biomolekülen mit Röntgenstrahlen werden bislang noch Kristalle benötigt, die bei den Röntgenlasern aber aufgrund von deren hoher Lichtintensität extrem klein sein können. Enzymkristalle und Antibiotikum-Lösung werden sehr schnell vermischt, und die Reaktion startet, wenn das Antibiotikum in den Enzymkristall diffundiert. Durch die geringe Größe der Kristalle diffundieren die Antibiotika sehr schnell in den Kristall, so dass alle Beta-Lactamasemoleküle und die Antibiotika nahezu gleichzeitig miteinander reagieren. Dieses spezielle Mix-and-Inject-Verfahren erfordert maßgeschneiderte Injektoren, die die Arbeitsgruppe von Lois Pollack von der Cornell Universität in Ithaca, New York, für das Experiment bereitgestellt hat. Die Methode ermöglicht atomgenaue Zeitlupenaufnahmen von schnellen Prozessen, and denen Enzyme und anderen Biomoleküle beteiligt sind.
„Enzyme wie Beta-Lactamase sind für die Medizin von großer Bedeutung“, erklärt Marius Schmidt. „Röntgenlaser wie der European XFEL ermöglichen es heute, sehr viel kleinere Kristalle als früher zu untersuchen. Unser Experiment hat gemeinsam mit früheren Ergebnissen gezeigt, wie Röntgenlaser künftig als wichtiges Werkzeug der biologischen Forschung genutzt werden können.“
