XFEL: Antibiotikaresistenz von Bakterien auf der Spur
Antibiotikaresistenz von Bakterien auf der Spur

Künstlerische Darstellung des Experiments: Treffen die ultrahellen Röntgenblitze (violett) die Enzymkristalle im Wasserstrahl (blau) lässt sich aus dieser Durchleuchtung die dreidimensionale Form des Enzyms (rechts) rekonstruieren. Bild: DESY/Lucid Berlin
Eine große internationale Forschergruppe unter Beteiligung von European XFEL-Wissenschaftlern hat die Ergebnisse der ersten wissenschaftlichen Experimente am European XFEL im Fachblatt „Nature Communications" veröffentlicht. Zu den im September 2017 kurz nach Eröffnung der Anlage erzielten Resultaten gehören auch neue Strukturdaten eines Enzyms, das eine wichtige Rolle bei der Entwicklung von Antibiotika-Resistenzen beim Bakterium Klebsiella pneumoniae spielt, einem Keim der in Krankenhäusern weltweit ein Problem darstellt. Die Publikation ist die zweite Veröffentlichung zu Forschungsergebnissen die am European XFEL erzielt wurden.
„Die Pionierexperimente des ersten Nutzerteams am European XFEL ebnen den Weg für alle nachfolgenden, die erheblich hiervon profitieren“, betont European XFEL-Geschäftsführer Prof. Robert Feidenhans'l. „Die Ergebnisse zeigen, dass die Anlage noch besser funktioniert als erwartet und im besten Zustand ist, um neue wissenschaftliche Durchbrüche zu liefern.“

Forschungsleiter Dr. Anton Barty (links) von DESY und European-XFEL-Forscher Dr. Richard Bean an der Messstation SPB/SFX. Bild: DESY, Lars Berg
„Da wir als erste an einer völlig neuen Anlage gearbeitet haben, mussten wir zahlreiche Herausforderungen meistern, die zuvor noch niemand angegangen war“, betont DESY-Forscher Anton Barty vom Center for Free-Electron Laser Science (CFEL), der das Team von rund 125 Wissenschaftlerinnen und Wissenschaftlern geleitet hat. „Man kann es mit dem Jungfernflug eines neuartigen Flugzeugs vergleichen: Sämtliche Berechnungen und die gesamte Montage sind getan, alles sagt, es wird funktionieren – aber erst wenn man es versucht, wird man wissen, ob es wirklich fliegt.“
Wichtige Vorausetzung für den erfolgreichen „Jungfernflug“ war es, die große Anzahl und schnelle Frequenz von Pulsen des Röntgenlasers so gut wie möglich zu nutzen, neue Methoden für den Probentransport in den Röntgenstrahl zu entwickeln und sicherzustellen, dass der eigens für den European XFEL entwickelte AGIPD-Detektor die großen Datenmengen verarbeiten kann. Adrian Mancuso, leitender Wissenschaftler an der SPB/SFX-Experimentierstation, an der die Experimente durchgeführt wurden: „Das gute Zusammenspiel aller notwendigen Faktoren bei diesen ersten Experimenten ist das Ergebnis der harten Arbeit und des Engagements vieler Beteiligter. Das schließt die vielen beteiligten Forscherinnen und Forscher ebenso ein wie Gruppen bei DESY wie beispielsweise das Beschleuniger-Team, zusammen mit dem SPB/SFX-Team und den vielen European XFEL - Mitarbeiterinnen und - Mitarbeiter die unsere Arbeit unterstützen, wie beispielsweise die Detektorgruppe. Nur mit Hilfe des Wissens und der Expertise aller Beteiligten konnten wir ein so erfreuliches Ergebnis erzielen. Das ist ein hervorragender Start für die Forschung an unserer neuen Einrichtung!"
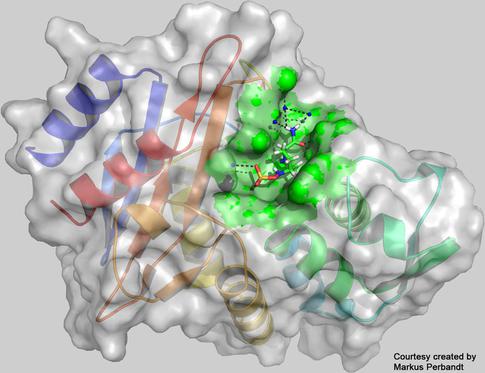
Die in den Messungen bestimmte dreidimensionale Struktur des Enzyms CTX-M-14-β-Laktamase mit dem daran gebundenen Inhibitor Avibactam am aktiven Zentrum (grün). Bild: Universität Hamburg, Markus Perbandt
Die Forscher konnten genug Daten einer neuen Proteinstruktur sammeln: eines Komplexes aus dem Enzym CTX-M-14-β-Laktamase aus dem Bakterium Klebsiella pneumoniae, dessen mehrfach resistente Stämme in Krankenhäusern weltweit zu gravierenden Problemen führen, zusammen mit dem Inhibitor Avibactam, der das Enzym hemmt. Das Enzym funktioniert wie eine Art molekulare Schere und zerschneidet Penizillin-Antibiotika, wodurch diese wirkungslos werden. Um dies zu vermeiden, werden Antibiotika häufig mit Avibactam zusammen verabreicht. Avibactam legt sich zwischen die Scherenblätter des Enzyms und blockiert so die Schneidefunktion. Durch Mutationen kann sich die Form der molekularen Schere jedoch so ändern, dass Avibactam und damit auch die Antibiotika wieder wirkungslos werden. In ihrem Experiment untersuchten die Forscher die Struktur des nicht mutierten Enzyms mit dem angekoppelten Avibactam. Beide Strukturen waren bereits zuvor bekannt, der Komplex aus beiden ist jedoch die erste am European XFEL neu bestimmte Proteinstruktur. In weiteren Experimenten wollen die Forscher noch mehr Daten sammeln, um einen „Molekülfilm“ zu produzieren, der zeigt, wie das Enzym und Avibactam aneinander koppeln. Diese Details können neue Anstöße zur Entwicklung von Therapien liefern.
DESY Pressemitteilung:
"Erste Experimente an neuem Röntgenlaser enthüllen unbekannte Struktur von Antibiotika-Killer"
Originalarbeit:
„Megahertz serial crystallography“; Max O. Wiedorn, Dominik Oberthür, Richard Bean, Robin Schubert, Nadine Werner et al.; „Nature Communications“, 2018; DOI: 10.1038/s41467-018-06156-7
Siehe auch:
Erste Ergebnisse von Experimenten am European XFEL veröffentlicht
